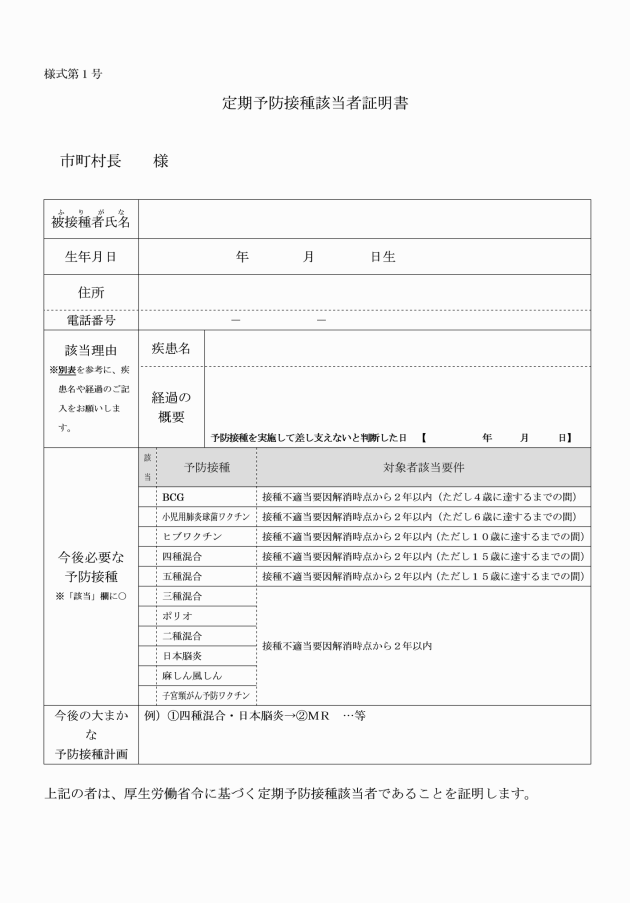
○智頭町定期予防接種実施要綱
平成25年3月31日
告示第107号
第1 主旨
予防接種法(昭和23年法律第68号)に基づき智頭町が実施する定期の予防接種に関し必要な事項を定めるものとする。実施にあたっては、予防接種ガイドライン等検討委員会が示した「予防接種ガイドライン」を参考にするものとする。
第2 予防接種の種類、対象者及び接種方法
1 ジフテリア、百日せき、破傷風、急性灰白髄炎(ポリオ)の予防接種
(1) 第1期
ア 対象者
生後2月から生後90月未満までの者
イ 標準的な接種時期
初回接種の標準的な接種時期は、生後2月から生後12月未満までとし、追加接種の標準的な接種時期は、初回接種終了後12月から18月に達するまでの期間とする。
ウ 使用ワクチン
沈降精製百日せきジフテリア破傷風不活化ポリオ混合ワクチンを使用する。
エ 接種回数、接種間隔及び接種方法
(ア) 初回接種
初回接種として20日以上、標準的には20日から56日までの間隔をおいて3回皮下に注射するものとする。接種量は毎回0.5mlとする。
(イ) 追加接種
追加接種として初回接種終了後6月以上、標準的には12月から18月までの間隔をおいて1回皮下に注射するものとする。接種量は0.5mlとする。
(2) 第2期
ア 対象者
11歳以上13歳未満の者
イ 標準的な接種時期
標準的な接種時期は、11歳から12歳に達するまでの期間とする。
ウ 使用ワクチン
沈降ジフテリア破傷風混合トキソイド(以下「二種混合ワクチン」という。)を使用する。
エ 接種回数及び接種方法
二種混合ワクチンを1回皮下に注射するものとする。接種量は、0.1mlとする。
2 ジフテリア、百日せき、破傷風、急性灰白髄炎(ポリオ)、Hib感染症の予防接種
(1) 第1期
ア 対象者
生後2月から生後90月未満までの者
イ 標準的な接種時期
初回接種の標準的な接種時期は、生後2月から生後12月未満までとし、追加接種の標準的な接種時期は、初回接種終了後12月から18月に達するまでの期間とする。
ウ 使用ワクチン
沈降精製百日せきジフテリア破傷風不活化ポリオヘモフィルスb型混合ワクチンを使用する。
エ 接種回数、接種間隔及び接種方法
(ア) 初回接種
初回接種として20日以上、標準的には20日から56日までの間隔をおいて3回皮下又は筋肉内に注射するものとする。接種量は毎回0.5mlとする。
(イ) 追加接種
追加接種として初回接種終了後6月以上、標準的には12月から18月までの間隔をおいて1回皮下に注射するものとする。接種量は0.5mlとする。
(2) 第2期
ア 対象者
11歳以上13歳未満の者
イ 標準的な接種時期
標準的な接種時期は、11歳から12歳に達するまでの期間とする。
ウ 使用ワクチン
沈降ジフテリア破傷風混合トキソイド(以下「二種混合ワクチン」という。)を使用する。
エ 接種回数及び接種方法
二種混合ワクチンを1回皮下に注射するものとする。接種量は、0.1mlとする。
3 麻しん、風しんの予防接種
(1) 第1期
ア 対象者
生後12月以上24月未満の者。ただし、麻しんと風しんの両方に罹患歴のある者を除く。
イ 使用ワクチン
乾燥弱毒生麻しん風しん混合ワクチンを使用する。ただし、保護者が希望する場合にあっては、乾燥弱毒生麻しんワクチンと乾燥弱毒生風しんワクチンの接種に代えることができるものとする。
ウ 接種回数及び接種方法
乾燥弱毒生麻しん風しん混合ワクチン、乾燥弱毒生麻しんワクチン及び乾燥弱毒生風しんワクチンのいずれも、1回皮下に注射するものとする。接種量は、0.5mlとする。
(2) 第2期
ア 対象者
小学校就学の前年度(いわゆる保育園及び幼稚園の年長児の1年間をいう。)にある者。ただし、麻しんと風しんの両方に罹患歴のある者を除く。
イ 使用ワクチン
乾燥弱毒生麻しん風しん混合ワクチンを使用する。ただし、保護者が希望する場合にあっては、乾燥弱毒生麻しんワクチンと乾燥弱毒生風しんワクチンの接種に代えることができるものとする。
ウ 接種回数及び接種方法
乾燥弱毒生麻しん風しん混合ワクチン、乾燥弱毒生麻しんワクチン及び乾燥弱毒生風しんワクチンのいずれも、1回皮下に注射するものとする。接種量は、0.5mlとする。
(3) 第5期
ア 対象者
昭和37年4月2日から昭和54年4月1日の間に生まれた男性。ただし、風しん抗体検査を受けた結果、別表第2に定めた抗体価を超える十分な量の風しんの抗体があることが判明した者は除く。
イ 使用ワクチン
原則、乾燥弱毒生麻しん風しん混合ワクチンを使用する。ただし、本人が希望する場合にあっては、乾燥弱毒風しんワクチンの接種に代えることができるものとする。
ウ 接種回数及び接種方法
乾燥弱毒生麻しん風しん混合ワクチン、及び乾燥弱毒生風しんワクチンのいずれも、1回皮下に注射するものとする。接種量は、0.5mlとする。
エ 抗体検査及び接種期間
平成31年4月1日から令和7年3月31日までとする。
4 日本脳炎の予防接種
(1) 第1期
ア 対象者
生後6月から生後90月未満までの者
イ 標準的な接種時期
初回接種の標準的な接種時期は、3歳から4歳に達するまでの期間とし、追加接種の標準的な接種時期は、4歳から5歳に達するまでの期間とする。
ウ 使用ワクチン及び接種回数、接種方法
(ア) 初回接種
乾燥細胞培養日本脳炎ワクチンを、初回接種として6日以上、標準的には6日から28日までの間隔をおいて2回皮下に注射するものとする。接種量は、毎回0.5mlとする。ただし、3歳未満の者にあっては、0.25mlとする。
(イ) 追加接種
乾燥細胞培養日本脳炎ワクチンを、追加接種として初回接種終了後6月以上、標準的にはおおむね1年(おおむね1年とは、初回接種終了後11月から13月までを指すものとする。)を経過した時期に1回皮下に注射するものとする。接種量は、0.5mlとする。ただし、3歳未満の者にあっては、0.25mlとする。
(2) 第2期
ア 対象者
9歳以上13歳未満の者
イ 標準的な接種時期
標準的な接種時期は、9歳から10歳に達するまでの期間とする。
ウ 使用ワクチン及び接種回数、接種方法
乾燥細胞培養日本脳炎ワクチンを1回皮下に注射するものとする。接種量は、0.5mlとする。
(3) 特例対象者の第1期接種
ア 特例対象者
平成7年4月2日から平成19年4月1日までに生まれた者で第1期接種が完了していない20歳未満の者
イ 接種方法
(ア) 平成22年3月31日までに第1期初回接種を1回受けている者
乾燥細胞培養日本脳炎ワクチンを6日間以上の間隔をおいて2回皮下に注射するものとする。接種量は、毎回0.5mlとする。
(イ) 平成22年3月31日までに第1期初回接種を2回受けている者
乾燥細胞培養日本脳炎ワクチンを1回皮下に注射するものとする。接種量は、0.5mlとする。
(ウ) 第1期接種を全く受けていない者
乾燥細胞培養日本脳炎ワクチンを、初回接種として6日以上、標準的には6日から28日までの間隔をおいて2回皮下に注射し、追加接種として初回接種終了後6月以上、標準的にはおおむね1年(おおむね1年とは、初回接種終了後11月から13月を指すものとする。)を経過した時期に1回皮下に注射するものとする。接種量は、毎回0.5mlとする。
(4) 特例対象者の第2期接種
ア 特例対象者
平成7年4月2日から平成19年4月1日までに生まれた者で第1期接種完了後6日間以上経過した9歳以上20歳未満の者
イ 使用ワクチン及び接種回数、接種方法
乾燥細胞培養日本脳炎ワクチンを1回皮下に注射するものとする。接種量は、0.5mlとする。ただし、第1期追加接種からは6日間以上の間隔をあけるものとする。
5 結核の予防接種
(1) 対象者、接種方法等
ア 対象者
生後12月未満の者
イ 標準的な接種期間
標準的な接種時期は生後5月に達した時から生後8月に達するまでの期間とする。
ウ 使用ワクチン及び接種回数、接種方法
経皮接種用乾燥BCGワクチンを1回、BCG用管針を用いて経皮に注射するものとする。
(2) コッホ現象出現時の対応等
BCG接種後10日頃に針痕部位に発赤が生じ、接種後1月から2月までの頃に化膿巣が出現する。結核既感染者にあっては、接種後10日以内に接種局所の発赤、腫脹及び針痕部位の化膿等を来たすこと(以下「コッホ現象」という。)がある。
ア 保護者に対する周知
予防接種の実施に当たって、コッホ現象に関する情報提供及び説明を行い、次の事項を保護者に周知しておく。
(ア) コッホ現象と思われる反応が被接種者にみられた場合は、速やかに接種医療機関を受診させること。
(イ) コッホ現象が出現した場合は、接種局所を清潔に保つ以外の特別の処置は不要である。反応が起こってから、びらんや潰瘍が消退するまでの経過がおおむね4週間を超える等治癒が遷延する場合は、混合感染の可能性もあることから、接種医療機関を受診させること。
6 子宮頸がん予防ワクチンの接種
(1) 対象者
12歳になる年度(小学校6年生の相当の年度)の初日から16歳になる年度(高校1年生相当の年度)の末日までにある女性
(2) 使用ワクチン
組換え沈降2価ヒトパピローマウイルス様粒子ワクチン(以下「サーバリックス」という。)、又は組換え沈降4価ヒトパピローマウイルス様粒子ワクチン(以下「ガーダシル」という。)、又は組換え沈降9価ヒトパピローマウイルス様粒子ワクチン(以下「シルガード9」という。)のいずれかを使用する。なお、1回目の接種に使用したワクチンを3回目まで継続して使用することとする。
(3) 接種回数及び接種方法
ア サーバリックスの接種
サーバリックスを1月以上の間隔をおいて2回筋肉内に注射した後、第1回目の注射から5月以上かつ第2回目の注射から2月半以上の間隔をおいて1回筋肉内に注射するものとし、接種量は、毎回0.5mlとする。
イ ガーダシルの接種
ガーダシルを1月以上の間隔をおいて2回筋肉内に注射した後、3月以上の間隔をおいて1回筋肉内に注射するものとし、接種量は、毎回0.5mlとする。
ウ シルガード9の接種
シルガード9を1月以上の間隔をおいて2回筋肉内に注射した後、3月以上の間隔をおいて1回筋肉内に注射するものとし、接種量は、毎回0.5mlとする。
ただし、15歳未満で1回目を接種する場合、5月以上の間隔をおいて2回筋肉内に注射するものとし、接種量は、毎回0.5ミリリットルとすることを可能とすることとする。
(4) キャッチアップ接種
ア 対象者
平成9年4月2日から平成19年4月1日までの間に生まれた女子で3回接種を完了していない者
イ 接種期間
令和4年4月1日から令和7年3月31日の3年間
ウ 過去に接種歴がある者
過去に子宮頸がん予防ワクチンの接種歴があり、長期にわたり接種を中断していた者は、残りの回数の接種(2・3回目又は3回目)を行う。2・3回目は従来どおり、標準的な接種方法をとることができない場合の間隔とする。また、過去に接種歴のあるHPVワクチンと同一の種類のワクチンを使用すること。ただし、過去に接種した子宮頸がん予防ワクチンの種類が不明である場合、キャッチアップ接種を実施する医療機関の医師と被接種者とで十分に相談した上で、接種するワクチンを選択すること。
(5) ヒトパピローマウイルス感染症の定期接種の対応については、「ヒトパピローマウイルス感染症に係る定期接種の今後の対応について」(令和3年11月26日付け健発1126第1号厚生労働省健康局長通知)のとおりであること。
(6) 次に掲げる者については、ヒトパピローマウイルス感染症の予防接種後に広範な疼痛又は運動障害を中心とする多様な症状が発生する場合があるため、予診に当たっては、これらの者の接種について慎重な判断が行われるよう留意すること。
ア 外傷等を契機として、原因不明の疼痛が続いたことがある者
イ 他のワクチンを含めて以前にワクチンを接種した際に激しい疼痛や四肢のしびれが生じたことのある者
(7) ヒトパピローマウイルス感染症の予防接種に当たっては、ワクチンを接種する目的、副反応等について、十分な説明を行った上で、かかりつけ医など被接種者が安心して予防接種を受けられる医療機関で行うこと。
(8) 組換え沈降2価ヒトパピローマウイルス様微粒子ワクチンと組換え沈降4価ヒトパピローマウイルス様粒子ワクチンの互換性に関する安全性、免疫原性、有効性に関するデータはないことから、同一の者に両ワクチンを使用せず、同一のワクチンを使用すること。
(9) ヒトパピローマウイルス感染症の予防接種後に血管迷走神経反射として失神があらわれることがあるので、失神による転倒等を防止するため、注射後の移動の際には、保護者又は医療従事者が腕を持つなどして付き添うようにし、接種後30分程度、体重を預けられるような場所で座らせるなどした上で、なるべく立ち上がらないように指導し、被接種者の状態を観察する必要があること。
(10) ヒトパピローマウイルス感染症の予防接種後に広範な疼痛又は運動障害を中心とする多様な症状が発生した場合、次に掲げる事項について適切に対応すること。
ア 法の規定による副反応報告の必要性の検討
イ 当該予防接種以降のヒトパピローマウイルス感染症の予防接種を行わないことの検討
ウ 神経学的・免疫学的な鑑別診断及び適切な治療が可能な医療機関の紹介
7 インフルエンザ菌b型(ヒブ)ワクチンの接種
(1) 対象者
生後2月から生後60月未満までの者
(2) 標準的な接種
ア 標準的な接種開始時期
生後2月から生後7月未満までに接種を開始するものとする。
イ 使用ワクチン及び接種回数、接種方法
(ア) 初回接種
乾燥ヘモフィルスb型ワクチン(以下「ヒブワクチン」という。)を、初回接種として27日(医師が必要と認めた場合にあっては、20日)以上、標準的には27日(医師が必要と認めた場合には20日)から56日までの間隔をおいて3回皮下に注射するものとする。接種量は、毎回0.5mlとする。ただし、初回2回目及び3回目の接種は生後12月未満までに行うものとし、それを超えた場合は実施しない。
(イ) 追加接種
ヒブワクチンを、追加接種として初回接種終了後7月以上、標準的には7月から13月までの間に1回皮下に注射するものとする。接種量は、0.5mlとする。初回2回目及び3回目の接種を完了せずに、生後12月を超えた場合の追加接種は初回接種に係る最後の注射終了後、27日(医師が必要と認めた場合には20日)以上の間隔をおいて1回行うこととする。
(3) 標準的な接種の機会を逃した者の接種
ア 生後7月以上、標準的には7月から12月未満までの者
ヒブワクチンを、初回接種として27日(医師が必要と認めた場合にあっては、20日)以上、標準的には27日(医師が必要と認めた場合には20日)から56日までの間隔をおいて2回、追加接種として初回接種終了後7月以上、標準的には7月から13月までの間に1回皮下に注射するものとする。接種量は、毎回0.5mlとする。ただし、2回目の接種は生後12月未満に行うものとし、生後12月以降は実施しない。生後12月を超えた場合の追加接種は初回接種に係る最後の注射終了後、27日(医師が必要と認めた場合には20日)以上の間隔をおいて1回行うこととする。
イ 生後12月から60月未満までの者
ヒブワクチンを、1回皮下に注射するものとする。接種量は、0.5mlとする。
8 小児用肺炎球菌ワクチンの接種
(1) 対象者
生後2月から生後60月未満までの者
(2) 標準的な接種
ア 標準的な接種開始時期
生後2月から生後7月未満までに接種を開始するものとする。
イ 使用ワクチン及び接種回数、接種方法
(ア) 初回接種
沈降13価及び15価肺炎球菌結合型ワクチン(以下「小児用肺炎球菌ワクチン」という。)を、初回接種として標準的には生後12月までに27日以上の間隔で3回皮下に注射するものとする。ただし、2回目及び3回目の接種は生後24月未満に行うものとし、それを超えた場合は実施しない。接種量は、毎回0.5mlとする。また、初回2回目の接種は生後12月未満に行うものとし、それを超えた場合は初回3回目の接種は実施しない。
(イ) 追加接種
小児用肺炎球菌ワクチンを、追加接種として初回接種終了後60日以上の間隔をあけ、かつ、生後12月以降に1回皮下に注射するものとする。接種量は、0.5mlとする。なお、当該接種は標準的な接種期間として生後12月から15月までの間に行う。
(3) 標準的な接種機会を逃した者の接種
ア 生後満7月から12月未満までの者
小児用肺炎球菌ワクチンを、初回接種として標準的には生後12月までに27日以上の間隔で2回、追加接種として初回接種終了後60日以上の間隔をあけ、かつ、生後12月以降に1回皮下に注射するものとする。ただし、初回接種2回目の接種は、生後24月以降は実施しない。接種量は、毎回0.5mlとする。
イ 生後12月から24月未満までの者
小児用肺炎球菌ワクチンを、60日以上の間隔で2回皮下に注射するものとする。接種量は、毎回0.5mlとする。
ウ 生後24月から60月未満までの者
小児用肺炎球菌ワクチンを、1回皮下に注射するものとする。接種量は、0.5mlとする。
9 水痘ワクチンの接種
(1) 対象者
生後12月から生後36月未満までの者
(2) 標準的な接種
1回目の接種は、生後12月から生後15月に達するまでの期間に行う。6月から12月までの間隔をおいて2回行う。
(3) 接種方法
乾燥弱毒生水痘ワクチンを3月以上の間隔をおいて2回皮下に注射するものとし、接種量は、毎回0.5mlとする。
(4) 過去の任意接種の取扱い
ア 平成26年10月1日より前に、生後12月以降に3月以上の間隔をおいて2回乾燥弱毒生水痘ワクチンを接種した者は、定期接種を終了したものとみなす。
イ 平成26年10月1日より前に、生後12月以降に3月未満の間隔をおいて2回乾燥弱毒生水痘ワクチンを接種した者及び乾燥弱毒生水痘ワクチンを1回接種した者は、定期接種を1回接種したものとみなす。当該者が、平成26年10月1日以降に、生後12月から生後36月までの間にあり、定期接種を実施する場合は、生後12月以降の初めての接種から3月以上の間隔をおいて1回の接種を行い、定期接種を終了したものとみなすこと。
10 B型肝炎ワクチンの接種
(1) 対象者
平成28年4月1日以降に生まれた、1歳未満の者
(2) 対象者から除外される者
HBs抗原陽性の者の胎内又は産道においてB型肝炎ウイルスに感染するおそれのある者であって、抗HBs人免疫グロブリンの投与に併せて組換え沈降B型肝炎ワクチンの投与を受けたことのある者。
(3) 標準的な接種時期
ア 1歳未満の者
組換え沈殿B型肝炎ワクチンを使用し、生後2月になった時から生後9月になるまでの期間を標準的な接種期間として、27日以上の間隔をおいて2回接種した後、1回目の接種から139日以上の間隔をおいて3回目を接種すること。接種量は、毎回0.25mlとする。
イ 予防接種の開始時に1歳以上10歳未満の者(長期療養特例の対象者)
組換え沈降B型肝炎ワクチンを27日以上の間隔をおいて2回接種した後、1回目の接種から139日以上の間隔をおいて3回目を接種するものとし、摂取量は毎回0.25mlとする。ただし、2回目の接種の開始時に10歳以上である者にあっては、2回目以降の摂取量は0.5mlとする。
ウ 予防接種の開始時に10歳以上である者(長期療養特例の対象者)
組換え沈殿B型肝炎ワクチンを使用し、27日以上の間隔をおいて2回接種した後、1回目の接種から139日以上の間隔をおいて3回目を接種すること。接種量は、毎回0.5mlとする。
(4) 平成28年10月1日より前の接種の取り扱いについて
平成28年10月1日より前(定期の予防接種が開始される前)の注射であって、定期の予防接種のB型肝炎の注射に相当するものについては、当該注射を定期の予防接種のB型肝炎の注射と、当該注射を受けた者とみなして、以降の接種を行う。
11 ロタウイルス予防接種
(1) 対象者
ア 1価ロタウイルスワクチン(以下「ロタリックス」という。)は令和2年8月1日以降に生まれた者で、生後6週から生後24週未満の者
イ 5価ロタウイルスワクチン(以下「ロタテック」という。)は令和2年8月1日以降に生まれた者で、生後6週から生後32週未満の者
(2) 対象から除外される者
腸重積症の既往歴があることが明らかな者、先天性消化管障害を有する者(その治療が完了した者を除く。)及び重症複合免疫不全症の所見が認められる者
(3) 使用ワクチン
ロタリックスまたはロタテックのいずれかを使用する。なお、2回目以降は1回目に用いたワクチンと同一種類のワクチンで行うこととする。
(4) 標準的な接種時期
ア ロタリックス
初回接種は生後2月から14週6日までに行う。初回接種後27日以上間隔をおいて2回目を接種する。経口接種で、接種量は毎回1.5mlとする。
イ ロタテック
初回接種は生後2月から14週6日までに行う。初回接種後27日以上間隔をおいて2回目を行い、2回目接種後27日以上の間隔をおいて3回目を行う。経口接種で、接種量は毎回2mlとする。
(5) 標準的な接種機会を逃した者の接種
出生15週0日後以降の初回接種については、安全性が確立されていないため、出生14週6日後までに初回の接種を完了させることが望ましい。※出生15週0日後以降に初回接種を行う場合、上記について十分に説明を行い、同意が得られた場合に接種すること。
(6) 吐き戻した場合の対応について
接種後、児がワクチンを吐き戻した場合は再度の接種は行わない。
(7) 令和2年10月1日より前の接種の取り扱いについて
令和2年10月1日より前(定期の予防接種が開始される前)の経口投与であって、定期の予防接種のロタウイルスワクチンに相当するものについては、当該経口投与をロタウイルス感染症の定期接種とみなして、以降の接種を行う。
12 高齢者インフルエンザ予防接種
(1) 対象者
ア 65歳以上の者
イ 60歳以上65歳未満の者であって、心臓、腎臓又は呼吸器の機能に自己の身辺の日常生活行動が極度に制限される程度の障がいを有する者及びヒト免疫不全ウイルスにより免疫の機能に日常生活がほとんど不可能な程度の障がいを有する者
(2) 接種方法
インフルエンザHAワクチンを毎年度1回皮下に注射するものとし、接種量は、0.5mlとする。
13 新型コロナウイルス感染症予防接種
(1) 対象者
ア 65歳以上の者
イ 60歳以上65歳未満の者であって、心臓、腎臓又は呼吸器の機能に自己の身辺の日常生活行動が極度に制限される程度の障がいを有する者及びヒト免疫不全ウイルスにより免疫の機能に日常生活がほとんど不可能な程度の障がいを有する者
(2) 接種方法
コロナウイルスワクチンを毎年度1回筋肉内に接種するものとする。
14 高齢者肺炎球菌感染症予防接種
(1) 対象者
ア 65歳の誕生日前日から66歳の誕生日を迎える前日まで
イ 60歳以上65歳未満の者であって、心臓、腎臓又は呼吸器の機能に自己の身辺の日常生活行動が極度に制限される程度の障がいを有する者及びヒト免疫不全ウイルスにより免疫の機能に日常生活がほとんど不可能な程度の障がいを有する者
(2) 接種方法
23価肺炎球菌莢膜ポリサッカライドワクチンを1回筋肉内又は皮下に注射するものとし、接種量は0.5mlとする。
(3) 過去の任意接種の取扱い
23価肺炎球菌莢膜ポリサッカライドワクチンを1回以上接種した者は、当該予防接種を定期接種として受けることはできない。
(4) 接種歴の確認
高齢者の肺炎球菌感染症の予防接種を行うに当たっては、予診票により、当該予防接種の接種歴について確認を行うこと。
第3 長期の療養を要する疾病により定期接種の機会を逸した者への接種機会の確保
上記第2で定める対象者であった期間中に、定期接種実施要領(平成25年3月30日付健発0330第2号)の長期にわたり療養を必要とする疾病にかかった者等及び別表に定めるもの、その他予防接種施行規則で定める特別の事情があることにより予防接種を受けることができなかったと認められるものについて、当該特別の事情がなくなった日から起算して2年(高齢者の肺炎球菌感染症に係る定期接種を受けることができなかったと認められるものについては、当該特別の事情がなくなった日から起算して1年)を経過するまでの間、当該疾病に係る定期接種の対象者とする。
ただし、BCGについては4歳未満であること、四種混合については15歳未満であること、ヒブワクチンについては10歳未満であること、小児用肺炎球菌ワクチンについては6歳未満であること、B型肝炎については接種年齢の上限を設けないこととする。
第4 実施者
予防接種を実施することができるのは、智頭町長の依頼を承諾した医師とし、智頭町長に承諾書(様式第3号)を提出している者とする。なお、承諾書は3年間有効とし、その間に承諾書の内容に変更が生じた場合は再度承諾書を提出するものとする。3年経過後は、改めて承諾書を提出するものとする。
第5 実施期間
通年とする。
ただし、第2の9で定める高齢者インフルエンザ予防接種及び、新型コロナウイルス感染症予防接種は10月から翌年の1月までとする。
第6 実施方法並びに注意事項
1 接種対象者の確認
医療機関は、接種券又はクーポン券を受け取り、母子健康手帳(以下「母子手帳」という。)、又は保険証や運転免許証等で当該予防接種の対象者であることを確認する。
2 予診
当該予防接種の対象者であることを確認のうえ、十分な予診を行う。また、予診に併せ、予防接種の効果、副反応及び予防接種健康被害救済制度について適切な説明を行い、予防接種実施について予診票で同意を確認した上で予防接種を実施する。
3 使用ワクチンの確認
使用するワクチンは、当該予防接種のものであることと、別表第1に掲げる有効期限内であって適正に保管されたものであることを確認の上接種する。
4 母子健康手帳及び予診票の記載
接種年月日、ワクチン名、ロット番号、接種医師名を記入する。なお、使用ワクチン名、ロット番号は、記入またはシール(ワクチンの箱に添付)を貼付するものとする。
5 アレルギー精密検査
接種するワクチンに対してアレルギー反応が予測される場合は、アレルギー精密検査実施医療機関にあっては、アレルギー精密検査を実施した上で接種の可否を決定する。また、アレルギー精密検査実施医療機関以外の医療機関にあっては、アレルギー精密検査実施医療機関に紹介する。
6 BCG予防接種におけるコッホ現象の取扱い
医師はコッホ現象を診断した場合、保護者の同意を得て、定期接種実施要領(平成25年3月30日付健発0330第2号)様式第六において定める「コッホ現象事例報告書」を用い、智頭町へファクシミリにて直ちに報告すること。この場合において、個人情報の取り扱いには十分配慮すること。
第7 接種不適当者(「予防接種ガイドライン」参照)
接種の前に、被接種者について予診票によるほか、原則として視診、聴打診等の方法によって健康状態を調べ、被接種者が次のいずれかに該当すると認められる場合には、接種を行ってはならない。
(1) 明らかな発熱を呈している者
(2) 重篤な急性疾患にかかっていることが明らかな者
(3) 当該疾病に係る予防接種の接種液の成分によって、アナフィラキシーを呈したことが明らかな者
(4) 日本脳炎予防接種、子宮頸がん予防ワクチンの女性対象者にあっては、妊娠していることが明らかな者
(5) BCG接種対象者にあっては、外傷等によるケロイドが認められる者
(6) その他予防接種を行うことが不適当な状態にある者
第8 接種の判断を行うに際し、注意を要する者
接種の前に、被接種者について予診票によるほか原則として視診、聴打診等の方法によって健康状態を調べ、被接種者が次のいずれかに該当すると認められる場合には、被接種者の健康様態及び体質を勘案し、慎重に予防接種の適否を判断するとともに、説明に基づく同意を確実に得る。
(1) 心臓血管系疾患、腎臓疾患、肝臓疾患、血液疾患及び発育障害等の基礎疾患を有することが明らかな者
(2) 予防接種で接種後2日以内に発熱がみられた者及び全身性発疹等のアレルギーを疑う症状を呈したことがある者
(3) 接種しようとする接種液の成分に対して、アレルギーを呈するおそれのある者
(4) 過去にけいれんの既往がある者
(5) 過去に免疫不全の診断がなされている者及び近親者に先天性免疫不全症の者がいる者
(6) BCGについては、過去に結核患者との長期の接触がある者その他の結核感染の疑いのある者
第9 自己負担金
町長は、予防接種法第28条の規定により、ワクチンの予防接種を受けた者(第10において「被接種者」という。)又はその保護者に対し、次に定めるワクチンの種類に応じ、それぞれに定める額を自己負担金として徴収するものとする。
(1) 高齢者インフルエンザワクチン 次に掲げる被接種者の区分に応じ、それぞれ定める額
ア 本人及び世帯員全員が町民税を課されていない者 無料
イ ア以外の者 1件につき 1,500円
(2) 新型コロナウイルス感染症ワクチン 次に掲げる被接種者の区分に応じ、それぞれ定める額
ア 本人及び世帯員全員が町民税を課されていない者 無料
イ ア以外の者 1件につき 1,500円
(3) 高齢者肺炎球菌ワクチン 次に掲げる被接種者の区分に応じ、それぞれ定める額
ア 本人及び世帯員全員が町民税を課されていない者 無料
イ ア以外の者 1件につき 2,000円
第10 委託料
委託料は、披接種者一人1回につき委託契約書の定めるところの額とする。
第11 委託料の請求及び支払い
1 委託料の請求は、請求書(指定用紙)に接種券及び予診票を添付の上、接種した日の属する月の翌月10日までに智頭町へ持参又は送付するものとする。
2 支払いは、医療機関の指定する金融機関への口座振り込みとする。既に登録済みの口座、代表者名等に変更のある場合は、変更届を智頭町へ届け出るものとする。
3 風しん予防接種第5期については、医療機関は抗体価検査及び接種を行った場合、これに要した費用を鳥取県国民健康保険団体連合会に抗体価検査受診票及び予防接種予診票を添えて請求するものとする。鳥取県国民健康保険団体連合会は、医療機関から請求があった場合、抗体価検査受診票及び予防接種予診票を添えて智頭町に請求するものとする。智頭町は、鳥取県国民健康保険団体連合会から請求があった場合、その額を支払うものとする。
第12 償還払いによる助成
1 抗体検査又は予防接種の対象者が、やむを得ない事情がある場合、抗体検査に係る費用については別表第3、予防接種に係る費用については委託契約書に定めるところの額を上限として償還払いにより助成を行うことができるものとする。
2 前項の申請は、抗体検査及び予防接種費用助成申請書(様式第4号)に、次の各号の区分に応じ、当該各号に定める書類を添付して行うものとする。
(1) 抗体検査
ア 抗体検査に係る領収書原本
イ 抗体検査実施日、検査方法及び検査結果が記載された書類の写し
(2) 予防接種
ア 予防接種に係る領収書原本
イ 接種済証又は接種記録の記載された母子手帳の写し。風しん第5期については予診票又は接種済証の写しと風しん抗体価の分かるものの写し。
第13 予防接種後副反応報告
医師等が予防接種法に基づく予防接種による副反応(「予防接種後副反応報告基準」に該当する症状)あるいはその疑いのある患者を診察した場合は、定期の予防接種等による副反応の報告等の取扱いについての一部改正について(平成26年9月26日付健発0926第1号)様式1において定める「予防接種後副反応報告書」を用い、厚生労働省及び智頭町へファクシミリにて直ちに報告すること。この報告は、予防接種を行った医師以外の医師等も行うものとする。この場合において、個人情報の取り扱いには十分配慮すること。なお、予防接種後副反応報告は、予防接種との因果関係の有無に関係なく予防接種後に一定の健康状況の変化を来した症例について報告を行うものであり、これらの症例の中には、予防接種によって引き起こされた反応だけでなく、予防接種との関連性が考えられない紛れ込み事例も含まれる可能性があるため、予防接種健康被害救済制度と直接結びつくものではない。
第14 予防接種健康被害救済制度
予防接種法に基づく定期の予防接種を受けた者が疾病にかかり、障害の状態となり、又は死亡した場合において、当該疾病、障がい又は死亡が当該予防接種を受けたことによるものであると厚生労働大臣が認定したときは、智頭町が予防接種法の規定に基づき医療費などの給付を行う。
予防接種健康被害救済給付は、本人又はその保護者の申請によるため、医師が申請が必要と考えられる症例を診察した場合には、保護者へ予防接種健康被害救済制度の申請について紹介する。
第15 個人情報の保護
個人情報の取り扱いについては、別記「個人情報取扱特記事項」を遵守しなければならない。
附則
この要綱は、平成25年4月1日から施行する。
附則(平成25年8月20日告示第209号)
この要綱は、平成25年8月20日から施行する。
附則(平成25年10月11日告示第237号)
この要綱は、平成25年11月1日から施行する。
附則(平成26年3月31日告示第82号)
1 この要綱は、平成26年4月1日から施行する。
2 平成26年4月1日より前に、旧規則に規定する接種の間隔を超えて行った接種であって、新規則に規定する予防接種に相当する接種を受けた者は、医師の判断と保護者の同意に基づき、既に接種した回数分の定期接種を受けたものとしてみなすことができるものとする。
附則(平成26年9月29日告示第207号)
この要綱は、平成26年10月1日から施行する。
附則(平成26年10月27日告示第221号)
この要綱は、平成26年10月27日から施行する。
附則(平成27年3月27日告示第115号)
この要綱は、平成27年4月1日から施行する。
附則(平成28年3月31日告示第143号)
この要綱は、平成28年4月1日から施行する。
附則(平成28年9月28日告示第204号)
この要綱は、平成28年10月1日から施行する。
附則(平成29年9月29日告示第234号)
この要綱は、平成29年10月1日から施行する。
附則(平成30年10月1日告示第199号)
この要綱は、平成30年10月1日から施行する。
附則(平成31年4月1日要綱第97号)
この要綱は、平成31年4月1日から施行する。
附則(令和元年10月1日告示第274号)
この要綱は、令和元年10月1日から施行する。
附則(令和2年4月1日要綱第93号)
この要綱は、公布の日から施行する。
附則(令和2年9月30日要綱第288号)
この要綱は、公布の日から施行する。
附則(令和3年4月1日告示第108号)
この要綱は、令和3年4月1日から施行する。
附則(令和3年8月31日告示第215号)
この要綱は、令和3年10月1日から施行する。
附則(令和4年4月1日要綱第257号)
この要綱は令和4年4月1日から施行する。
附則(令和4年8月31日要綱第276号)
この要綱は令和4年10月1日から施行する。
附則(令和5年4月1日告示第118号)
この要綱は、令和5年4月1日から施行する。
附則(令和6年4月1日要綱第258号)
この要綱は、令和6年4月1日から施行する。
別表第1
ワクチンの貯法と有効期間一覧
製剤名 | 貯法 | 有効期限 | |
不活化ワクチン | 沈降精製百日せきジフテリア破傷風不活化ポリオ混合ワクチン | 遮光し凍結を避けて10℃以下 | 製造日から1.5年、2年、2.5年 |
沈降ジフテリア破傷風混合トキソイド | 遮光し凍結を避けて10℃以下 | 2年 | |
乾燥細胞培養日本脳炎ワクチン | 遮光して10℃以下 | 製造日から2年、3年 | |
組換え沈降2価/4価/9価ヒトパピローマウイルス様粒子ワクチン | 遮光し凍結を避けて2~8 | 3年、製造日から3年 | |
乾燥ヘモフィルスb型ワクチン | 遮光し2~8℃ | 製造日から3年 | |
沈降13価肺炎球菌結合型ワクチン | 凍結を避け2~8℃ | 製造日から3年 | |
沈降15価肺炎球菌結合型ワクチン | 凍結を避け2~8℃ | 製造日から3年 | |
インフルエンザHAワクチン | 10℃以下 | 1年 | |
23価肺炎球菌莢膜ポリサッカライドワクチン | 遮光して8℃以下 | 2年 | |
組換え沈降B型肝炎ワクチン | 遮光し凍結を避け10℃以下 | 検定合格日から2年 | |
生ワクチン | 乾燥弱毒生麻しん風しん混合ワクチン | 遮光して5℃以下 | 1年、製造日から1.5年 |
乾燥弱毒生麻しんワクチン | 遮光して5℃以下 | 1年 | |
乾燥弱毒生風しんワクチン | 遮光して5℃以下 | 2年 | |
乾燥BCGワクチン | 10℃以下 | 3年 | |
乾燥弱毒生水痘ワクチン | 遮光して5℃以下 | 2年 | |
経口生ワクチン | 経口弱毒性ヒトロタウイルスワクチン | 遮光し凍結を避けて2℃から8℃ | 製造日から3年 |
5価経口弱毒性ロタウイルスワクチン | 遮光し凍結を避けて2℃から8℃ | 製造日から2年 | |
別表第2
風しん第5期の接種の対象となる風しん抗体価
測定キット名(製造販売元) | 検査方法 | 抗体価 (単位等) |
風しんウイルスHI試薬「生研」 (デンカ生研株式会社) | 赤血球凝集抑制法 (HI法) | 8倍以下(希釈倍率) |
R―HI「生研」 (デンカ生研株式会社) | 赤血球凝集抑制法 (HI法) | 8倍以下 (希釈倍) |
ウイルス抗体価EIA「生研」ルベラIgG (デンカ生研株式会社) | 酵素免疫法 (EIA法) | 6.0未満 (EIA価) |
エンザイグノストB風疹/IgG (シーメンスヘルスケア・ダイアグノスティクス株式会社) | 酵素免疫法 (EIA法) | 15未満 (国際単位(IU)/ml) |
バイダス アッセイキット RUB IgG (シスメックス・ビオメリュー株式会社) | 蛍光酵素免疫法 (ELFA法) | 25未満 (国際単位(IU)ml) |
ランピア ラテックス RUBELLA (極東製薬工業株式会社) | ラテックス免役比濁法 (LTI法) | 15未満 (国際単位(IU)/ml) |
アクセス ルベラIgG (ベックマン・コールター株式会社) | 化学発光酵素免疫法 (CLEIA法) | 20未満 (国際単位(IU)/ml) |
i―アッセイ CL 風疹 IgG (株式会社保健科学西日本) | 化学発光酵素免疫法 (CLEIA法) | 11未満 (抗体価) |
BioPlex MMRV IgG (バイオ・ラッド ラボラトリーズ株式会社) | 蛍光免疫測定法 (FIA法) | 1.5未満 (抗体価AI) |
BioPlex ToRC IgG (バイオ・ラッド ラボラトリーズ株式会社) | 蛍光免疫測定法 (FIA法) | 15未満 (国際単位(IU)/ml) |
ランピア ラテックス RUBELLAⅡ (極東製薬工業株式会社) | ラテックス免疫比濁法 (LTI法) | 15未満 (国際単位(IU)/ml) |
バイオライン ルベラIgG/IgN (アボットジャパン株式会社) | イムノクロマト法 (ICA法) | 陰性 |
別表第3
風しん抗体検査の委託料単価
HI法、LTI法 | EIA法、ELFA法、CLEIA法、FIA法 | |
健診等の機会に行う場合 | 1,290円 | 2,680円 |
医療機関を受診して行う場合 | 4,930円 | 6,320円 |
時間外に医療機関を受診して行う場合 | 6,320円 | 6,820円 |
備考 この表において「時間外」とは、午後6時から午前8時までの夜間及び早朝、土曜日午後、日曜日、祝日並びに12月29日から翌1月3日までの年末年始をいう。 この単価は消費税及び地方消費税を含まない。 | ||